Alzheimer's & Dementia︱陈宇/路中华/叶涛团队建立首个阿尔茨海默病基因编辑猕猴模型发现早期病理和免疫分子改变
阿尔茨海默病(Alzheimer’s disease, AD)是发病率最高、病因复杂的神经退行性疾病之一,目前仍缺乏能有效改变AD发展进程的治疗手段。传统AD相关啮齿类动物模型(如转基因及人源化小鼠模型)极大的加深了我们对AD发病机制的理解,然而,由于小鼠与人类在遗传背景、大脑结构、认知行为和免疫系统方面存在较大差异,啮齿类动物模型并不能完全反映人类阿尔茨海默病的复杂性。非人灵长类动物(如猕猴属食蟹猴)在进化、脑结构和功能方面与人类更为相似,开发AD相关非人灵长类动物模型,有望为揭示灵长类特异的AD疾病发生机制提供新的机遇。

文章上线截图(点击文末链接查看全文)
7月7日,中国科学院深圳先进技术研究院(以下简称“深圳先进院”)脑认知与脑疾病研究所/深港脑科学创新研究院陈宇/路中华/叶涛团队在Alzheimer's & Dementia: The Journal of the Alzheimer's Association期刊在线发表题为“Early blood immune molecular alterations in cynomolgus monkeys with a PSEN1 mutation causing familial Alzheimer’s disease”的研究论文。研究通过基因编辑技术建立首个精准模拟家族性AD基因突变的猕猴模型(PSEN1突变食蟹猴),并在幼年AD突变猴中发现AD相关早期病理蛋白的改变以及外周炎症和免疫信号分子的异常。
PSEN1是常染色体显性阿尔茨海默病(家族性AD,通常65岁之前发病)的最常见致病基因,编码γ-secretase复合体(APP经β-secretase和γ-secretase连续剪切产生Aβ)的催化核心亚基组份。家族性AD PSEN1 exon9缺失突变(PSEN1-ΔE9)携带者通常在45-57岁左右发病。在本研究中,团队首先通过双向导RNA-CRISPR/Cas9介导的胚胎基因编辑,成功获得5只携带家族性AD PSEN1-ΔE9突变的食蟹猴。Exon9编码PSEN1的蛋白剪切位点,exon9的缺失引起突变猴来源细胞中PSEN1蛋白水解剪切的改变,并影响其作为亚基的γ分泌酶的活性(如剪切APP影响Aβ代谢)。为进一步确认PSEN1突变猴能否表现出AD相关早期疾病特征的改变,团队检测了幼年猴脑脊液中AD相关核心生物标志物的变化,结果显示,PSEN1突变猴脑脊液表现出exon9突变剂量依赖性的Aβ42,Aβ42/40比例的升高,以及p-tau217/total tau比例的升高(图1)。该PSEN1突变食蟹猴模型是报道的首个精准模拟AD致病突变的猕猴模型,幼年PSEN1突变猴脑脊液中AD核心生物标志物变化提示该模型在模拟AD早期疾病发生方面具有重要潜力。
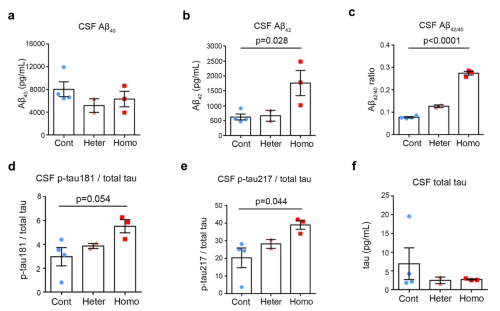
图1. PSEN1突变猴脑脊液中AD相关生物标志物的变化
为进一步揭示AD发展进程中的潜在早期分子信号改变,从而为解析早期疾病发生机制、发展早期分子诊断方法提供新的线索,研究团队对幼年食蟹猴进行了血液转录组和血浆蛋白组的检测,结果显示,在幼年AD突变食蟹猴中,其外周血液系统已经开始出现大量炎症和免疫反应相关信号分子的改变(图2),提示早期外周免疫反应异常可能在AD进程中发挥重要作用。
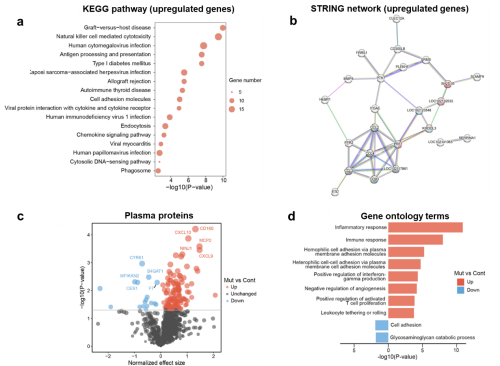
图2. PSEN1突变猴血液中炎症和免疫相关分子改变
综上所述,本研究通过建立首个精准模拟阿尔茨海默病致病突变的基因编辑食蟹猴模型,在幼年突变猴中发现AD相关早期生物标志物以及大量外周免疫信号分子的异常。该研究为理解灵长类特异的AD早期疾病发生机制、探索和评价早期诊断干预手段提供了新的实验模型和研究途径。

论文通讯作者陈宇(左五)、路中华(右四)、叶涛(左四)与论文共同第一作者李梦奇(左三)、管明峰(左二)、林剑邦(左一)、朱凯川
深圳先进院陈宇研究员、路中华研究员和叶涛副研究员为该论文的通讯作者,工程师李梦奇、助理研究员管明峰、博士生林剑邦和高级工程师朱凯川为共同一作,深圳先进院为论文唯一通讯单位。感谢国家自然科学基金、广东省基础与应用基础研究基金粤港澳研究团队项目、深港脑科学创新研究院和深圳先进院脑所非人灵长类实验动物平台对本研究的支持。
点击查看:全文链接