脑未来科普 | 小心!肠道细菌可能影响你的社交
|
|
近些年来,作为大脑和外周器官的相互作用的代表,脑肠轴 (brain-gut axis)的调控概念已经被广泛接受。大脑和肠道相互作用主要包含两个基本的方面:大脑对肠道自上而下的作用(top-down)和肠道对大脑自下而上的作用(bottom-up),这种双向的调节作用对二者的正常功能十分重要。 由于肠道内存在非常丰富的神经元,因此肠道也被称作第二大脑,大脑可以通过与肠道之间丰富的神经联系对肠道功能进行调节;而反过来肠道如何作用于大脑的机制目前的研究还不够清楚。 |
2021年6月30日,Wei-Li Wu等在《自然》杂志发文,他们的研究表明肠道微生物可以通过影响大脑中的压力反应神经元来调节小鼠社交行为。
首先,作者发现肠道无菌(Germ-free, GF)小鼠会出现显著的社交缺陷,这与前人的研究一致;使用多联抗生素处理(antibiotic cocktail, ABX)引起肠道细菌耗竭的小鼠也显示出类似的表型,提示肠道菌群对小鼠的社交行为存在影响。
与此同时,这些出现社交缺陷的小鼠大脑内特定脑区的神经元出现显著激活,包括下丘脑室旁核(paraventricular nucleus of the hypothalamus, PVN),终纹床核(bed nucleus of stria terminalis, BNST)和海马齿状回(dentate gyrus, DG),基底外侧杏仁核(basolateral amygdala, BLA)也有神经元激活增多的趋势(c-fos染色阳性增多)。
值得注意的是,与压力应激密切相关的糖皮质激素皮质酮的水平也显著升高(图1)。
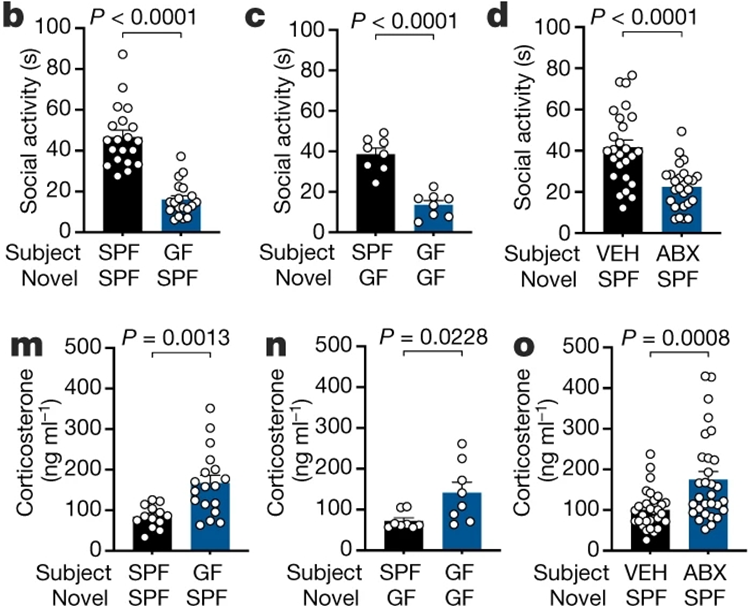
图1. 肠道微生物调控小鼠社交行为和皮质酮水平
接下来,作者使用药理学手段研究皮质酮的作用。美替拉酮(metyrapone, MET)是皮质酮合成阻断剂,小鼠腹腔注射MET能够显著提高GF小鼠社交水平,而对照组(carboxymethylcellulose, CMC)则无此效果。同时,注射皮质酮受体拮抗剂RU-486也能够达到类似的效果。
另外,由于皮质酮的合成主要发生在肾上腺,双侧肾上腺切除(adrenalectomy, ADX)的ABX小鼠也出现皮质酮合成明显降低,并能够逆转由于ABX小鼠处理引起的社交回避表型。
进一步,作者使用hSyn-Cre AAV病毒工具在不同脑区敲除糖皮质激素受体基因(encoding the glucocorticoid receptor, Nr3c1)。
结果显示,在小鼠DG和BNST敲除Nr3c1能提高ABX小鼠社交水平,降低皮质酮水平,RU-486系统性阻断皮质酮受体通路也仍能够改善ABX处理引起的社交障碍。
而与之相反,下丘脑(包含PVN脑区)敲除Nr3c1之后,ABX小鼠社交水平进一步降低,皮质酮水平则出现升高,显示下丘脑Nr3C1能够负性调控HPA轴作用。RU-486阻断皮质酮受体通路也不能够恢复下丘脑敲除Nr3c1小鼠ABX处理引起的社交障碍(图2)。这些结果表明不同脑区的糖皮质激素受体在调节社交行为中起到不同作用。
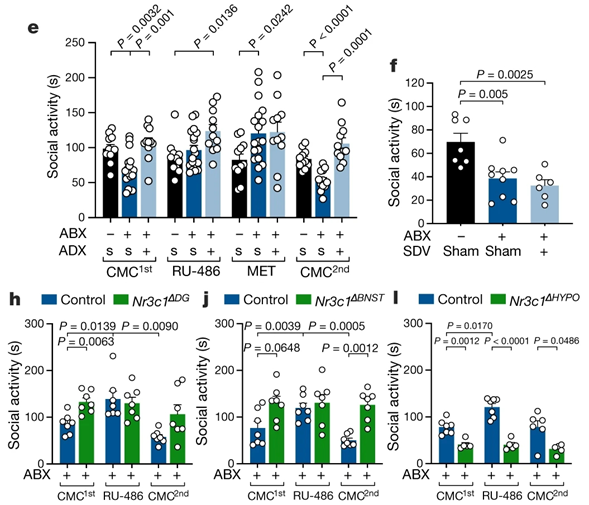
图2. 肠道微生物调控皮质酮信号通路改变社交行为
对不同脑区进行应激相关基因表达分析发现,crh (corticotrophin-releasing hormone)基因在ABX 处理引起的社交受损小鼠下丘脑中特异性表达升高。因此,作者使用抑制型药物遗传学工具验证下丘脑CRH+神经元功能。
在Crh-ires-Cre小鼠双侧PVN表达AAV包装的hM4Di病毒之后,使用CNO能够显著提升ABX处理小鼠的社交水平,同时显著降低皮质酮水平。PVN神经元的c-fos染色也显示激活神经元明显减少。
之后作者使用激活型药物遗传学工具hM3Dq病毒工具进一步验证CRH+神经元在野生型小鼠(而非GF和ABX)中的作用,结果表明,CNO激活CRH+神经元能够显著降低小鼠的社交水平(图3)。
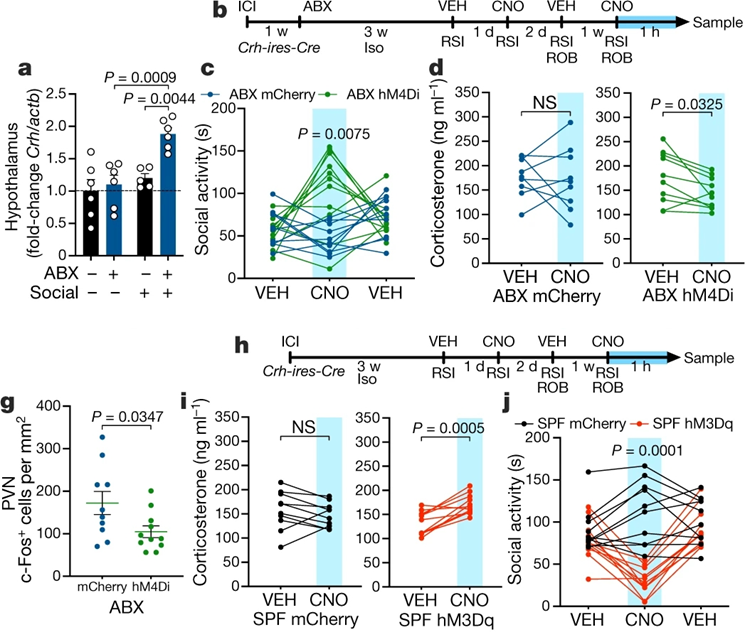
图3. CRH神经元和糖皮质激素受体调节社交行为
更进一步,作者希望确定对行为产生影响的具体肠道微生物。通过分别减少多联抗生素组合,即氨苄青霉素(ampicillin, A), 万古霉素(vancomycin, V), 新霉素(neomycin, N)和甲硝唑(metronidazole, M)中的单一组分发现,只有去除新霉素组的组合AVM能够提高社交水平,并降低社交接触之后的皮质酮水平。
更重要的是,AVM处理小鼠的肠菌移植到ABX小鼠肠道后能够恢复后者的社交水平,并降低皮质酮水平。
通过使用生物信息学分析比较AVM和ABX小鼠肠菌成分,作者分离鉴定出肠球菌属的一个亚群在上述小鼠社交受损过程中起重要作用,其中主要的细菌种类是粪肠球菌(Enterococcus faecalis),直接移植该细菌也能够逆转小鼠社交回避表型,并降低皮质酮水平(图4)。
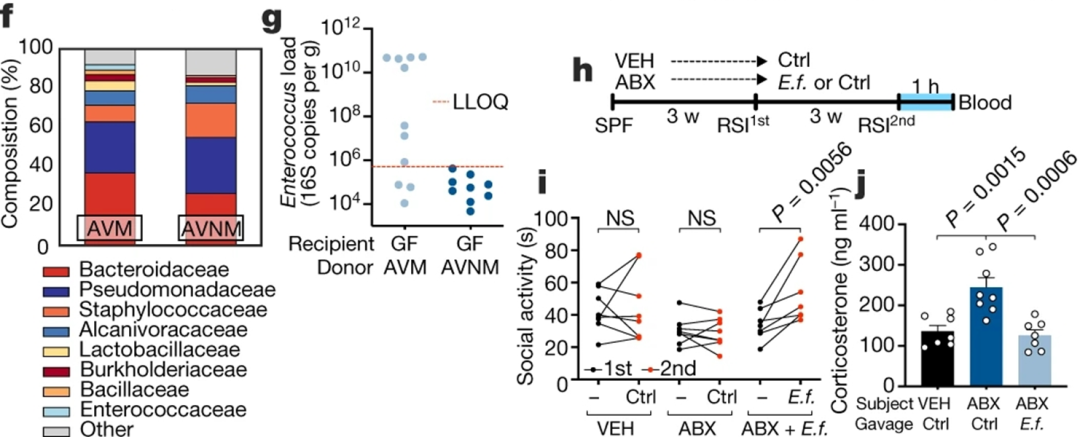
图4. 粪肠球菌移植恢复社交缺陷和皮质酮水平
本研究中,作者发现特定的肠道微生物通过调节大脑状态最终影响动物社交行为。
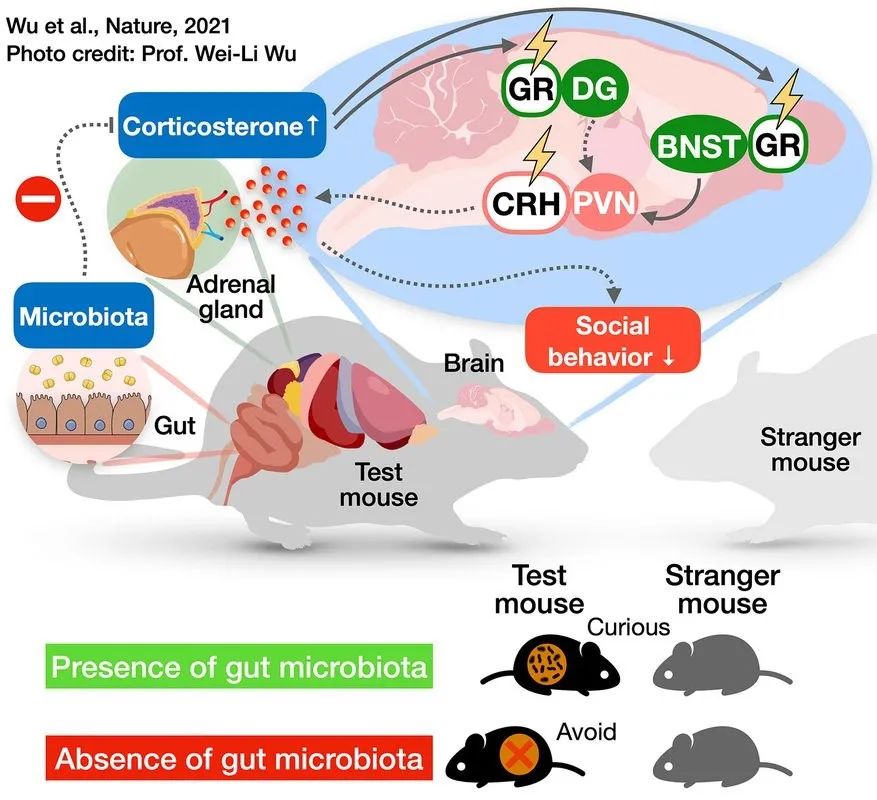
图5. 肠道菌群通过影响大脑皮质酮信号调节改变社交行为
该研究明确了特定的肠道微生物对大脑进行作用的机制,即肠球菌属微生物通过抑制皮质酮在脑内的响应水平,避免HPA轴过度激活引起的社交缺陷。
该研究为肠道微生物影响大脑神经元,并最终改变个体行为提供了新的证据,同时从“脑肠轴”的角度为社交障碍类精神疾病的临床治疗提供了参考依据。
参考文献
Wu, WL., Adame, M.D., Liou, CW. et al. Microbiota regulate social behaviour via stress response neurons in the brain. Nature 595, 409–414 (2021).
Abstract
Social interactions among animals mediate essential behaviours, including mating, nurturing, and defence. The gut microbiota contribute to social activity in mice, but the gut–brain connections that regulate this complex behaviour and its underlying neural basis are unclear. Here we show that the microbiome modulates neuronal activity in specific brain regions of male mice to regulate canonical stress responses and social behaviours. Social deviation in germ-free and antibiotic-treated mice is associated with elevated levels of the stress hormone corticosterone, which is primarily produced by activation of the hypothalamus–pituitary–adrenal (HPA) axis. Adrenalectomy, antagonism of glucocorticoid receptors, or pharmacological inhibition of corticosterone synthesis effectively corrects social deficits following microbiome depletion. Genetic ablation of glucocorticoid receptors in specific brain regions or chemogenetic inactivation of neurons in the paraventricular nucleus of the hypothalamus that produce corticotrophin-releasing hormone (CRH) reverse social impairments in antibiotic-treated mice. Conversely, specific activation of CRH-expressing neurons in the paraventricular nucleus induces social deficits in mice with a normal microbiome. Via microbiome profiling and in vivo selection, we identify a bacterial species, Enterococcus faecalis, that promotes social activity and reduces corticosterone levels in mice following social stress. These studies suggest that specific gut bacteria can restrain the activation of the HPA axis, and show that the microbiome can affect social behaviours through discrete neuronal circuits that mediate stress responses in the brain.
—— 作者介绍 ——
 |
申培磊 博士研究生 培养单位:中国科学院深圳先进技术研究院 研究方向:中枢神经调节外周器官功能 |
